Girêdan, girêdan, girêdan?
Contains
Hevdîtinên bi Elektrokîmyayê Beş 5
Di hevdîtinên berê de, me gelek mînakên hucreyên galvanîk dîtin - yên ku tenê girîngiya dîrokî ne û yên din ên ku îro têne bikar anîn. Cîhana hucreyan pir dewlemend e, ji ber vê yekê dem hatiye ku pergalên ji yên ku heya niha hatine xuyang kirin cûda werin destnîşan kirin.
Metalên nemetal jî dikarin bibin nîvxane
Pêşîn, ceribandinek ku du elektrodên grafîtê ji hêmanên Leclanchet ên xerckirî, zinc bromide ZnBr hewce dike.2, dabînkirina hêzê (wekî pîlê 4,5V) û metreyek voltaja domdar. Di laboratûara malê de, bê guman, em ê xwêya zincê ya pêşniyarkirî nebînin, lê di rewşa me de ew ê bi serfirazî bi tevliheviyek potassium bromide KBr û sulfate zinc (VI) ZnSO were guheztin.4. Em komek ku ji du çîpên grafîtê pêk tê berhev dikin, wê bi panelê ve girêdidin da ku elektrod bi qismî di camê de bin.
Em perçeyên têlan bi elektrodan ve girêdidin, bi tercîhî bi hesinek lêdanê (ji ber vê yekê, dema ku wan ji pîlê kevn derdixin, "kapikên" tûncê li ser darên grafît bihêlin). Em ê di heman demê de ji perçeyek kartonê diafragmayek bi pîvanên ku bi qalikek bi kapasîteya 50-100 cm ve hatî adaptekirin jî çêbikin.3 (karton dikare pêvek bi pînê were qul kirin).
Niha em hinek xwêyên navborî di nav avê de dihelînin û dûv re şûşê bi çareseriya amadekirî tije dikin (konsantre 5-10%). Refika bi elektrodê li ser keviya keştiyê bi cîh bikin, û dawiya têlan bi lewheyên tûncê yên bataryayek dagirtî ve girêdin (di gavê de polarîtî ne girîng e) û pergala çêkirî temaşe bikin.
Hema di cih de, qatek zirav-gewr zîv li ser elektrodê ku bi termînala neyînî ya pîlê ve girêdayî ye tê razandin. Ji zinc metallîk hatî çêkirin. Rengê qehweyî ya zer a çareseriyê li nêzî elektroda duyemîn a ku bi pola erênî ya pîlê ve girêdayî ye xuya ye. Bromîna belaş li nêzî darê grafîtê rengîn e. Piştî nêzîkî 5 hûrdem, têlan ji termînalên pîlê veqetînin. Bi voltmeterek bikar bînin, voltaja bipîvin ("minus" ya metre bi elektrodê ve girêdayî ye ku bi qatek metal ve girêdayî ye).
Bêyî ku em bikevin nav pêvajoyên ku di dema elektrolîzê de çêdibin (em ê di yek ji civînên jêrîn de li ser wan nîqaş bikin), em dikarin encam bidin ku şaneya hatî afirandin ji du elektrod pêk tê: zinc (zinka metal ku li ser grafît di çareyek Zn de hatî razandin.2+) û brom (çareseriya îyonên azad ên brom û bromîd Br?). Karbon tenê rêgirê elektrîkê ye (di pratîkê de, madeyên ne-reaktîf di bin hin mercan de, wek grafît, platîn, bi gelemperî wekî materyalên elektrodê têne bikar anîn).
Ka em wergirê heyî bi elektrodê ve girêdin? ampûlek bi voltaja xebitandinê ya 1,5 V (di vê rewşê de, polarîteya pêwendiyan jî ne girîng e). Gava ku enerjî ji pergalê tê derxistin, em gav bi gav windabûna depoya metal li ser yek elektrodê û rengê zer li ser din temaşe dikin. Madeyên ku berê hatine berdan bertek nîşan didin, rewşa xwe ya bingehîn vedigerînin. Reaksîyon nerasterast bi veguheztina elektronan bi têl girêdanê re ye. Ev cewhera hucreyên galvanîk e.
Di pergala me de çi bertek pêk hatin? Ji bo elektrodê zinc, em bê guman dikarin hevkêşeya pêvajoyê bidin:
(-)Zn0 ? çingo2+ + 2e-
Di elektroda duyemîn de, bromîna belaş ji bo anyonên bromê kêm dibe:
(+) Na.2 + 2e- , 2 pc-
Bi vî rengî, nexşeya hucreyê wiha ye (em îyonên potassium û sulfate (VI) yên ku di reaksiyonên reaksiyonê de beşdar nabin derdixin):
(-)C, Zn | ZnBr2aq? ZnBr2aq | C(+)
Em ne hewce ne ku di hucreyê de aperture bikar bînin. Lêbelê, karanîna wê dê pêşî li koçkirina bromîn li nêzîkê elektrodê zinc-pêçandî bigire û rasterast di navbera hucreyan de bertek nîşan bide.
Ne-metal mîna hêmanên metalîk nîv-şaneyan pêk tînin. Tenê pêdivî ye ku meriv rêgezek ku di nav çareseriyek maqûl de hatî nixumandin bikar bînin, ku dê beşdarî veguheztina elektronan bibe. Ji bo halojenan, potansiyelên standard wiha ne (reaksiyona elektrodê dişibihe ya ku ji bo bromînê tê dayîn):
| Half hucre | F2/F? | Cl2/ Cl? | Br2/ Br? | I2/I? |
| E0 [V] | 2,87 + | 1,36 + | 1,07 + | 0,54 + |
Di mijara florînê de, nirxa potansiyel (ji hemî nîv-şaneyên ku hatine destnîşankirin herî bilind) hate hesibandin, ne hate pîvandin. Sedem, wekî ku di metalên erda alkali û alkalîn de, reaksiyona hêmana çalak a bi avê re ye.
hucreya redox
Ji bo ceribandina paşîn, em ê çareseriyên jêrîn amade bikin: klorîdê hesin (III), FeCl3 bi giraniya 5%, potassium iodide KI bi giraniya 10% û suspensionek av-stêrk. Di lûleya testê de çend cm tevlihev bikin3 çareseriyên xwê, û piştî demekê çend dilop suspension starch lê zêde bike. Rengê şîn ê tarî yê naverokê hebûna îyota azad nîşan dide. Reaksîyon bi hevkêşeyê tê nivîsandin:
2 Fe3+ + 2i- ? 2Fe2+ + ez2
kationên hesin (III) anyonên îyodîd oksîde dikin û dibin hêmanek azad, û dibin îyonên hesin (II).
Guhertinek di rengê nîşana starchê de hebûna pariyên iyotê piştrast kir, lê gelo kationên Fe bi rastî têne çêkirin?2+? Werin em vê hîpotezê biceribînin. Testek taybetmendî ya ji bo tespîtkirina kationên hesin (II) reaksiyona bi heksasîanoferrate potasyum (III) K e.3[Fe(CN)6], bi gelemperî wekî potassium ferricyanide tê zanîn. Tevlîhev krîstalên sor çêdike, berevajî ferrocyanide potassium bi heman navî (potassium (II) hexacyanoferrate K.4[Fe(CN)6]) bi krîstalên zer ? em van her du têkiliyan tevlihev nekin. Em ceribandina berê dubare dikin, lê li şûna suspensionek starchê, em çend dilopên çareseriyek 1% ya potassium ferricyanide lê zêde dikin. Dîsa, naveroka keştiya reaksiyonê ji ber têkeliyek tevlihev a bi navê şîna Turnbull şîn dibe:
3 Fe2+ + 2[Fe(CN)6]3- ? Bawerî3[Fe(CN)6]2
Ez ji kafiran re pêşniyar dikim ku ceribandinek bi xwêyên hesinê hesin û ferîsê bikin. Em tenê di rewşa yekem de rengek şîn distînin.
Naha, di du fîncên piçûk ên bi kapasîteya 50-100 ml de, çend çareseriyên klorîdê hesin (III) û îyodîd potassium birijînin.3. Di her yek ji keştiyan de, elektrodek grafît bi têl ve girêdayî (li ser stûnek maqûl tê danîn da ku nekeve camê). Di heman demê de, piçek nişkêl li keştiyek bi çareseriya potassium iodide ve zêde bikin. Ji bo afirandina şaneyek, hûn ê hewceyê mifteyek elektrolîtîk jî bikin (di dema yek ji civînên berê de hatî çêkirin? Qîçek kaxezek blotê ya ku di nav çareseriyek konsantrekirî ya KNO de hatî şilkirin bes e.3). Dawiyên rêyên ji elektrodê bi termînalên metreyek gerdûnî ya ku ji bo pîvandina voltaja hatî saz kirin ve têne girêdan.
Em bi xwe polarîteya girêdanên voltmeterê li ser bingeha analîzek hevkêşeya reaksiyona kationên hesin (III) bi anyonên iyotê re diyar dikin, em bala xwe didin kîjan îyonan ew didin û kîjan elektronan distînin. Xwendinên metre operasyona hucreya galvanîk piştrast dikin. Dûv re em amûrê diguhezînin pîvana heyî. Ew piçûk e (ji rêza çend deh mA), ji ber vê yekê em ne hewce ne ku wergirek zêde bikar bînin (mînak, ampûlek) da ku amûrê ji zirarê biparêzin. Damezrandina rengek şîn a tarî li dora elektrodê ku di kaxezek bi çareseriya potassium iodide ve hatî nixumandin şahidiya reaksiyonê ya di pergalê de dike. Em kengê piçekî çareseriyek potasyum ferricyanide li şorkera hesin(III) zêde dikin? jî di wê de. Ka em hevkêşeyên pêvajoyên di qedehan de diqewimin binivîsin:
(-)2I- ? 2 + 2e-
(+)2Fe3+ + 2e- ? 2Fe2+
û diagrama hucreyê:
(-) Bi | CIaq || FeCl3aq | C (+)
Di hucreyê de heman reaksiyonên ku piştî tevlihevkirina substratan di lûleya ceribandinê de pêk tê ( bes e ku meriv pêvajoyên anodîk û katodî ji hêla aliyan ve lê zêde bike), û veqetandina cîhê ya veguherînan dihêle ku enerjiya elektronên ku hatine veguheztin bikar bînin. di navbera nîvên şaneyê de.
Ji şaneya ku em ava dikin re şaneya redoks tê gotin. Navê gelemperî lê şaş e. Beriya her tiştî, em dizanin ku pêvajoyên oksîdasyon û kêmkirinê di her girêdanê de pêk tê. Meriv çawa rêgeza reaksiyona redoxê (hem di hucreyek û hem jî di lûleya ceribandinê de pêk tê) diyar dike? Rêbaz hêsan e:
1. Di tabloyên fizîkî û kîmyayî de, gelo em potansiyelên standard ên nîv-şaneyên têkildar dibînin? ji bo pergala Fe3+/ Fe2+ ev e +0,77 V; bo min2/I?: +0,54V.
2. Pergalek bi potansiyelek bilindtir di reaksiyonê de oksîjenker e (xane-katod), û nîv-şaneyek bi potansiyelek kêmtir e? anoda şaneyê, ango kargêrê kêmkirinê.
3. Lêbelê, pêdivî ye ku ji bîr mekin ku ji bo pergalên ku di nirxên potansiyelên standard de cûdahiyek piçûk heye, di hin rewşan de, rol dikarin berevajî bibin (potansiyelên rastîn, di nav tiştên din de, bi giraniya reagentan ve girêdayî ne).
Hucreya sotemeniyê
Em ê pergalê ji ceribandina yekem kom bikin, tenê çareseriya potasyum bromide û zinc sulfate (VI) bi çareseriyek 10% ya asîda sulfurîk (VI) H veguherînin.2SO4. Piştî 1-2 hûrdeman ji elektrolîzê (bi berdana gazê ya li ser elektrodê çêdibe), çavkaniya hêzê qut bikin û bi baldarî, da ku bilbilên gazê ji rûyê grafît dernekevin, voltajê bi voltmeterê bipîvin. Girêdan hate afirandin! Piştî guheztina amûrê ber bi moda pîvana heyî ve, meriv dikare di dema reaksiyonê de windabûna bilbilên gazê yên li ser rûyê elektrodên grafît binihêre. Bêyî ku em bikevin nav hûrguliyên pêvajoya ku bûye sedema rabûna oksîjena azad û hîdrojenê li ser elektrodê, reaksiyonên di şaneyê de wiha ne:
(-) 2H2? 4 saetan+ + 4e-
(+) The2 + 4 XANÎ+ + 4e- ? 2h2O
Bi tevahî, reaksiyona senteza avê ji hêmanan pêk tê.

Pergala çêkirî modelek hucreya sotemeniyê ye. Veguheztina rasterast a enerjiya reaksiyonê ya di navbera sotemenî û oksîderê de li elektrîkê ji hêla aboriya pêvajoyê ve zehf bikêr e? Ne hewce ye ku germahiya şewitandinê veguherîne enerjiya hilmê, ku tenê turbînan dimeşîne. Ne ecêb e ku pergalên weha ji bo çareserkirina pirsgirêkên enerjiyê têne çêkirin (û çopê ava paqij e). Lêbelê, bihayê materyalên avahiyê û hewcedariya hilberîna hîdrojenê astengiyek mezin e.
Her çend şaneyên sotemeniyê ji bo hilberîna elektrîkê li deverên herî pêşkeftî yên teknolojîk, wekî firîna fezayê (di hin pîşesaziyan de, lêçûn rolek duyemîn dilîzin) hatine bikar anîn, dîroka wan pir dirêj e. Yekemîn prototîpa xebatê ya hucreya hîdrojen-oksîjenê ji hêla dahênerê Brîtanî William Robert Grove di sala 1839 de hate çêkirin.
Gotar gelek celeb girêdan pêşkêşî dike, ji yên ku di civînên berê de hatine nîqaş kirin. Mîna beşên mayî? tenê pirsgirêkên van pergalan, ku ne tenê wekî çavkaniya enerjiyê girîng in, têne destnîşan kirin. Lêbelê, hewcedariya domandina mezinahiyek nivîsê ya maqûl ne mumkun dike ku meriv li ser gelek mijarên balkêş ên girêdayî girêdanan nîqaş bike (Ez xwendevanên eleqedar teşwîq dikim ku bi xwe li agahdariyan bigerin). Di beşa paşîn a çerxê de, em ê tabloya potansiyelên nîv-hucreyê analîz bikin. Di heman demê de dê ezmûnên balkêş jî werin pêşkêş kirin.
serlêdana elektronîk
hucreya redox
Her şaneyek elektrokîmyayî di bin oksîdasyonê de (li anodê) û kêmkirinê (li katodê) derbas dibe. Lêbelê, di jargona kîmyewî de, hucreyên redox wekî celebek pergalê ya taybetî tête binav kirin.
Ji bo ceribandinê, çareseriyên potassium iodide KI û hesin (III) klorîd FeCl hewce ne.3 û suspensionek avî ya nîşayê (hevîra kartolê). Her weha hûn ê hewceyê mifteyek elektrolîtîk a ku bi çareseriyek konsantre ya nîtrata potassium (V) KNO dagirtî be3. Ger mifteyek me tune be, bes e ku em çend caran qapek kaxezek destmal an jî têlek pembû ya ku di nav çareseriyek nîtrata potassium de hatî avdan de biqelînin.
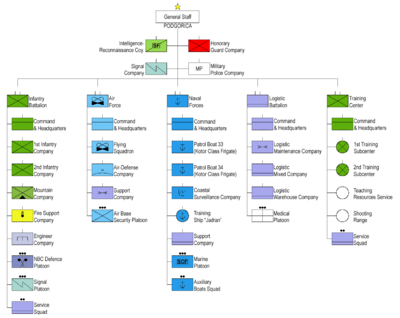
Em ê darên grafît ên ji hucreyên Leclanche yên hatine bikar anîn wekî elektrod bikar bînin (wêne 1). Dawiyên elektrodê bi têl ve girêbidin û bi çareseriyên KI-yê (bi lêzêdekirina çîpek nîþeþtê) û FeCl-ê di mêþkan de bihelînin.3. Wekî din, em çareseriyên di şûşeyan de bi mifteyek elektrolîtîk an yek ji cîgirên wê re berhev dikin (wêne 2). Piştî demekê, xêzikên binefşî bi çareseriya potassium iodide (wêne 3) dest pê dikin ku di kayê de xuya bibin (wêne 4), hêdî hêdî keştiyê bi rengek tarî dixemilînin (wêne 5 û XNUMX). Ew hilberek taybetmendiya berhevkirina molekulên îyotê yên belaş bi molekulên starchê re ye. Îyot di encama oksîdasyona anyonên îyodî de li anoda şaneyê pêk hat:
(-) Anod: 2I- ? 2 + 2e-
Li elektroda duyemîn (katod), îyonên hesin (III) kêm bûn:
(+) Katoda: 2Fe3+ + 2e- ? 2Fe2+
Hucreya redoxê ya ku di ceribandinê de hatî afirandin nexşeya jêrîn heye:
(-) C | CIaq || FeCl3aq | C (+)
ku nîşaneya karbonê C elektrodek grafît û || nîşan dide ? key elektrolîtîk. Reaksiyona giştî ya di pergalê de oksîdasyona anyonên I ye- ji hêla kationên Fe3+:
2 Fe3+ + 2i- ? 2Fe2+ + ez2
hucreya redox
hucreya konsantrasyonê
Ji bo ceribandina duyemîn hûn ê hewce bikin: çareseriyek sulfate sifir (II) CuSO4, elektrodên sifir, mifteya elektrolîtîk a ku bi çareseriyek konsantrekirî ya nîtrata potasyum (V) KNO tije ye3 û counter gerdunî. Yek ji qalikan bi çareseriya CuSO tije bikin.4û ya din jî bi heman rijandina 1:100 (mînak, 0,5 cm3 çareseriya ku ji şûşeya yekem hatî girtin, avê bi qasê 50 cm zêde bikin3) (wêne 6). Piştî ku têlên sifir di şûşeyan de binixumînin û bi mifteya elektrolîtîk dorpêç dikin, voltaja di navbera elektrodên şaneyê de bipîvin. Ew piçûk e? nêzîkî deh an çend deh millivolt (wêne 7).
Li ser elektrodê reaksiyonên belavbûna sifir û baranê çêdibin:
(-) Anod: Cu0 ? Bi2+ + 2e- (çareseriya kêm konsantre)
(+) Katod: Cu2+ + 2e- ? Bi0 (çareseriya bêtir konsantre)
Piştî lê zêdekirina hevkêşeyên her du pêvajoyên elektrodê, derdikeve holê ku bi tevahî reaksiyonek kîmyewî pêk nayê! Hêza ajotinê ya şaneyê tenê xwesteka pergalê ye ku hevsengiyên di her du qedehan de wekhev bike.